分子生成是一项典型的多目标优化任务。我们生成的分子不仅希望他具有好的亲和力,还需要有好的成药性,低的毒性,高的合成性等。
10月14日,第5期AIR学术工作坊第六位报告嘉宾:浙江大学药学院求是特聘教授侯廷军,为我们做了题为《AI药物发现的机遇与挑战》的报告。

侯廷军,浙江大学药学院求是特聘教授。长期围绕计算机辅助药物设计中的核心问题展开前沿交叉学科研究,在Nature Machine Intelligence、Nature Computational Science、Nature Protocols、Nature Communications、Chemical Reviews、Science Advances、Advanced Sciences、PNAS、ACS Central Science、Nucleic Acids Research、Briefings in Bioinformatics、Journal of Medicinal Chemistry等期刊发表SCI论文400余篇,引用25000余次(Google),H因子79;获授权专利和软件著作权70余项。任中国化学会计算(机)化学专业委员会副主任委员兼秘书长、中国计算机学会数字医学分会副主任委员,Briefings in Bioinformatics、Journal of Cheminformatics、Journal of Chemical Information and Modeling等14种SCI期刊编委或顾问编委。
侯教授首先介绍了AI药物发现领域的研究背景。在传统的药物发现过程中,创新药物存在研发周期长、投入高、风险大等问题。研发一款新药需要12年时间,并花费26亿美元的成本。同时,先导化合物的发现和优化是整个药物发现过程中最具挑战性的阶段。缺乏先导结构发现的关键技术也成为了新药研发成功率低的重要原因。先导化合物发现难的问题主要是因为化合物的化学空间非常大,可以达到10的60次方量级。同时先导物的筛选,优化和评价过程过于复杂。为了解决上述问题,整个创新药物发现需要一种全新的变革性的新模式。
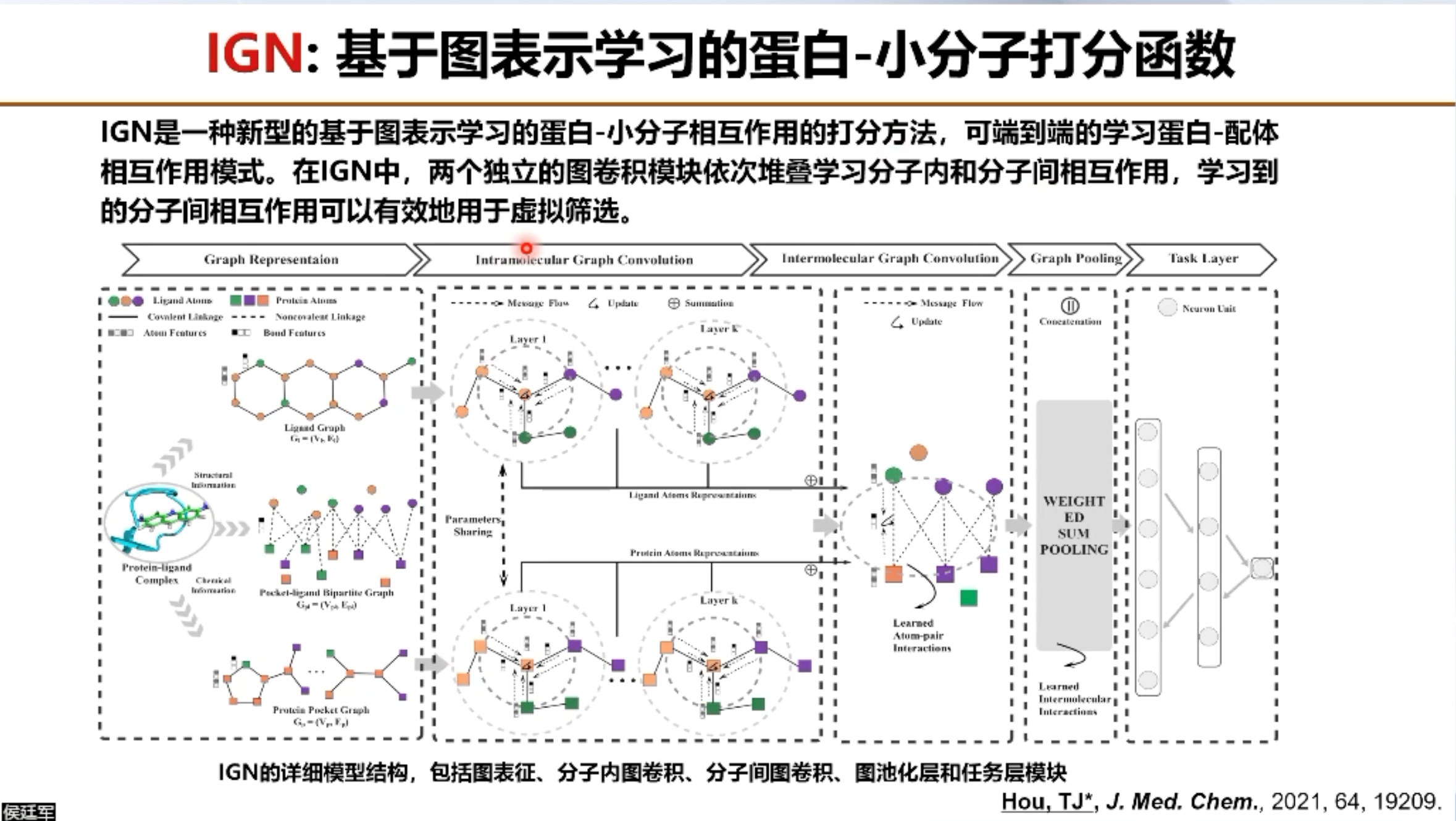
随后,侯教授详细介绍了他们实验室团队在AI辅助药物发现上的研究进展。首先侯教授介绍了团队在分子对接虚拟筛选方面的工作。分子对接指的是根据集合匹配和能量匹配原则,模拟两个及以上分子间的相互识别和结合的过程。影响分子对接预测精度的挑战有两个,一个是打分函数精度较差,一个是靶标的柔性对分子对接的影响无法准确评估。针对这些挑战,侯教授团队做了许多工作。IGN是团队研发的一种新型的基于图表示学习的蛋白-小分子相互作用的打分方法,可端到端的进行训练。RTMScore是一种基于残基-原子距离统计势的蛋白-配体打分函数。而KarmaDock则是基于深度学习的高通量分子对接框架,在PDBBind refined/core set上的对接精度超过传统对接软件,而对接速度较第二名也提升了163倍。同时在DEKOIS数据集上还展现出了超过传统分子对接方法的虚拟筛选能力。
接下来,侯教授介绍了团队在智能分子生成和优化方面的工作。侯教授表示,在分子生成领域,仅仅是生成新的分子已经无法满足人们的需求,对于分子生成模型的评价越来越多样性,不仅要考虑多样性和新颖性这些指标,还要评估其同时满足如靶标亲和力,好的成药性,低的毒性,高的合成性等目标的能力。
针对这一挑战,侯教授团队在分子生成和优化方面做了许多工作。基于配体的多约束分子生成方法MCMG, 通过知识蒸馏结合条件变换器和基于QSAR的强化学习算法来满足多约束条件,可以生成具有所需理化和药理学特性的新分子。该模型可以有效的平衡分子生成模型的收敛速度,在一定程度上解决了输出多样性的挑战问题。另一个工作是基于多尺度等变网络的蛋白口袋3D分子生成模型ResGen。该模型通过建模多尺度的等变神经网络,能够生成亲和力更强的新结构,缓解计算压力,并在基准数据集和几个验证靶标上达到了当前最佳效果。侯教授介绍的另一个工作是SurfGen,一种基于拓扑表面和几何结构的3D分子生成方法。该方法受启发于简单的锁-钥模型,使用了Geodesic-GNN和Geoattn-GNN技术,在平均对接打分上优于第二名20%,并能够生成与原配体在电子分布和形状上高度接近的分子。
接下来,侯教授进一步介绍了团队在分子成药性及安全性评估方面做出的努力。侯教授介绍到,频繁命中化合物是指在针对许多不相关靶点的筛选试验中都表现出阳性结果的化合物,而这也是高通量筛选中产生假阳性的主要原因。针对这一问题,侯教授团队对频繁命中化合物预测方面做了详尽的工作。同时,侯教授团队还研发了基于多图注意力模型的毒性预测方法MGA。该模型在31个毒性任务中表现出了优异的预测精度,优于现有的其他方法。侯教授团队还自研了成药性预测软件系统ADMETlab2.0,用于系统性的评价药物成药性和毒性。通过收集高质量数据集,并使用自研预测模型,使得该系统成为目前国际上最为优秀的,计算速度最快的计算平台之一。除此之外,侯教授团队研发了基于子结构掩盖的AI模型可解释性方法SME,对AI模型的可解释性提出了解决方法。
虽然这些模型方法取得了不错的效果,但是对于非计算机领域的人来说用起来还是有一定困难。因此侯教授介绍了他们研发的AI辅助药物设计软件DrugFlow和分子工厂。
此外,侯教授还介绍了AI辅助药物发现中一些尚未很好解决的问题和挑战。
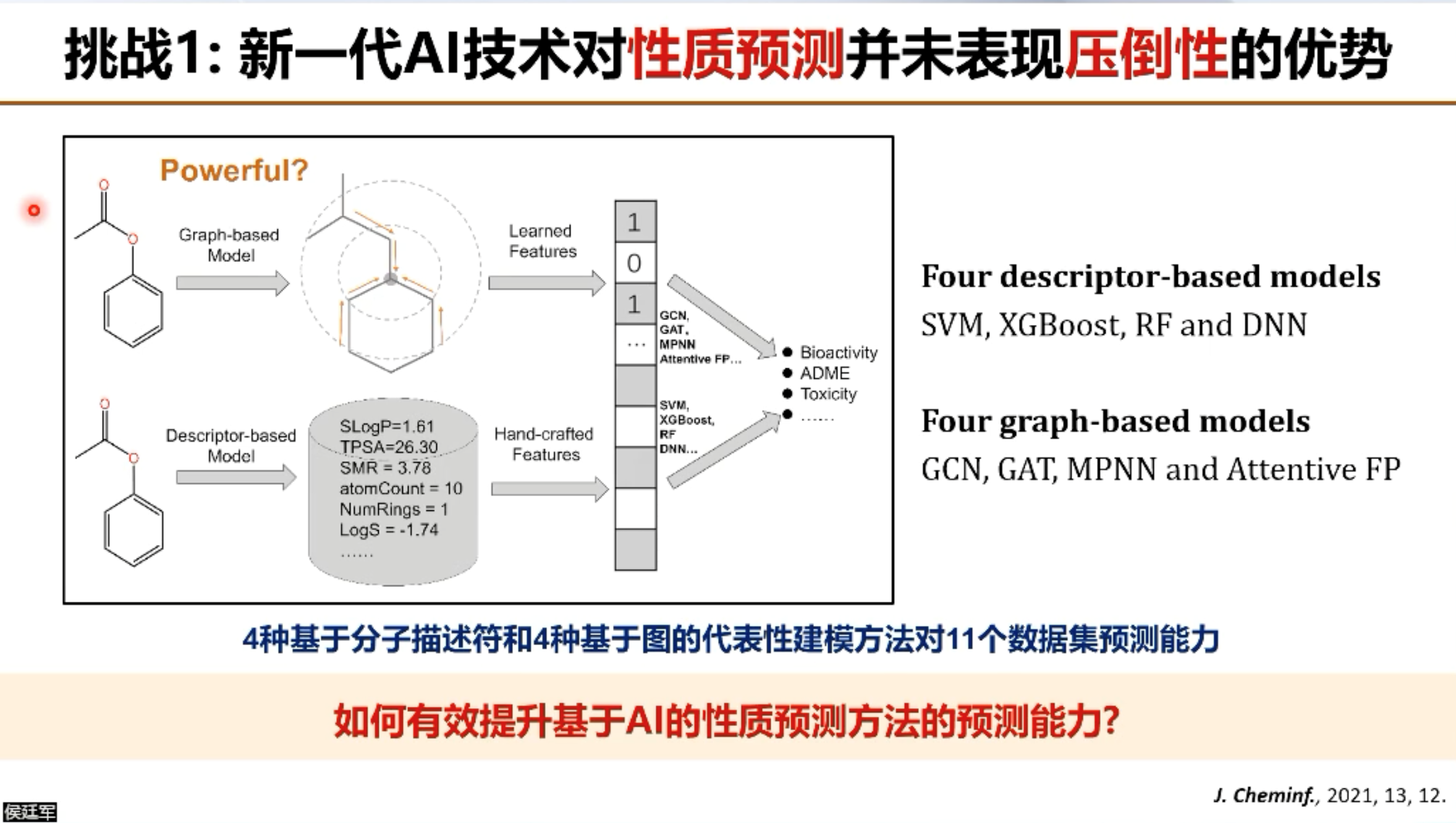
首先,最近几年新发展出来的AI技术,如图神经网络,注意力机制网络等,虽然在计算机视觉,自然语言处理等领域取得了成功,但是在药物发现领域,特别是性质预测方面,相比于传统的随机森林,支持向量机等方法,并没有表现出压倒性的优势。
其次,基于侯教授过去的实验表明,当前基于AI的方法虽然在亲和力预测方面展现出了不俗的能力,但在实际的虚拟筛选方面表现比较一般,并没有超越传统的分子对接方法。
最后,侯教授表示现在AI方法对于关键成药性参数和毒性终点预测精度都还比较低,无法满足药物研发的要求。这些问题在近几年有些取得了一定进展,但有些还尚未解决。基于以上几点,侯教授表示如何有效提升基于AI的性质预测方法的预测能力,如何有效提升基于AI的打分函数在虚拟筛选中的预测能力,如何有效提升关键成药性参数和毒性终点的预测精度,将是AI辅助药物发现领域未来需要重点关注的方向与挑战。